گاز ایدهآل یک تقریب از گازهای حقیقی است که برای مقاصد محاسباتی بکار میرود. گاز ایدهآل به گازی گفته میشود که:
- بین ذرات آن نیرویی وجود نداشته باشد و تنها برهمکنش بین ذرات، برخورد صلب باشد.
- اندازهٔ ذرات نسبت به مسیر آزاد میانگین ناچیز باشد.
گازهای حقیقی را در چگالیهای پایین با تقریب خوبی میتوان ایدهآل فرض کرد.
گازهای ایدهآل در حالت تعادل داخلی از معادلهٔ گاز ایدهآل پیروی میکنند:
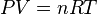
که در آن P فشار داخلی سیستم، V حجم سیستم، n تعداد مولهای ذرات سیستم، R ثابت جهانی گازها و T دمای سیستم با یکای کلوین است.
رای اثبات این قانون، اول لازم است که با قانونهای بویل و شارل آشنا شویم .
قانون بویل
رابطهٔ بین فشار و حجم یک گاز در 1662 میلادی توسط رابرت بویل ( Robert Boyle ) اندازه گیری شد . بویل متوجه شد که افزایش فشار وارد شده بر یک گاز با کاهش حجم آن متناسب است . اگر فشار دو برابر شود، حجم به نصف کاهش مییابد . اگر فشار سه برابر شود، حجم به یک سوم حجم اولیه اش میرسد . قانون بویل میگوید که در دمای ثابت، حجم گاز با فشار رابطهٔ عکس دارد :

قانون شارل
رابطهٔ بین حجم و دمای یک گاز در 1787 میلادی توسط ژاک شارل ( Jacques Charles ) مطالعه شد و نتایج او به طور قابل ملاحظهای توسط شاگردانش ژوزف گیلوساک ( Joseph Gay - Lussac ) گسترش یافت . براساس این قانون حجم تمام گازها، در فشار ثابت، با دمای مطلق آن گاز رابطهٔ مستقیم دارد :

قانون گازهای ایده آل
در دما و فشار ثابت حجم یک گاز با تعداد مولهای آن نسبت مستقیم دارد . حجم یک مول گاز نصف حجم اشغال شده توسط 2 مول گاز میباشد . بنابراین قانون و قوانین بویل و شارل میتوان گفت که :

با استفاده از یک عدد ثابت میتوان تناسب را به تساوی تبدیل کرد :

که از آن نتیجه میشود :
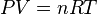
قانون گازهای ایده آل توسط نظریهٔ جنبشی گازها
نمونهای از یک گاز شامل N (عدد آووگادرو) مولکول، هر کدام با جرم m را در نظر بگیرید. اگر این نمونه در مکعبی با یال a باشد، حجم آن برابر خواهد شد با:
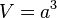
با فرض اینکه یک سوم مولکولها در جهت محور x، و دو سوم در جهت محورهای y و z حرکت کنند، آنگاه در هر ۲a حرکت یک مولکول گاز در جهت محور x داخل مکعب، مولکول حداقل یکبار به دیوارهٔ مکعب برخورد میکند. با فرض اینکه سرعت میانگین هر مولکول گاز برابر u است، در هر ثانیه هر مولکول گاز به اندازهٔ  برخورد دارد و در هر برخورد به اندازهٔ ۲mu اندازهٔ حرکت آن تغییر میکند. پس در هر ثانیه هر مولکول گاز به اندازهٔ زیر به دیوارهٔ مکعب نیرو وارد میکند :
برخورد دارد و در هر برخورد به اندازهٔ ۲mu اندازهٔ حرکت آن تغییر میکند. پس در هر ثانیه هر مولکول گاز به اندازهٔ زیر به دیوارهٔ مکعب نیرو وارد میکند :
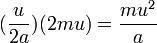
از این رو برای تمام مولکولهای گاز میتوان نوشت :

فشار عبارت است از نیرو بر سطح. پس :

پس میتوان نوشت :
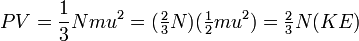
که KE در آن میانگین انرژی جنبشی مولکولی گاز میباشد. و از آنجا که انرزی جنبشی یک گاز (بنابر نظریه جنبشی گازها) با دمای مطلق آن نسبت مستقیم دارد و همچنین  ، پس :
، پس :

که با ضرب کردن عدد ثابتی مثل R، میتوان تناسب را به تساوی تبدیل کرد :
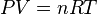
- فیزیک ( جلد دوم )، رابرت رزنیک، دیوید هالیدی، کنت اس . کرین، دکتر جلال الدین پاشایی راد، دکتر محمد خرمی، محمد رضا بهاری، مرکز نشر دانشگاهی، تهران ، 1381 ،
 آمار
وب سایت:
آمار
وب سایت:

